| معادل فارسی | تعریف | واژه لاتین |
| آنتالپی | محتوی گرمایی یک نمونه از ماده | enthalpy |
| آنتالپی تشکیل | برای یک ماده مرکب معین ، تغییر آنتالپی واکنشی که در آن ، یک مول ماده مرکب از پایدارترین شکلهای عناصر آن تشکیل می شود، آنتالپی تشکیل مینامند. | enthalpy of formation |
| قانون هس یا قانون جمعبندی ثابت گرما | تغییر آنتالپی واکنش شیمیایی ، ثابت است، خواه واکنش در یک مرحله ، خواه در دو مرحله انجام گیرد. | Hess,s law |
| قانون نسبتهای معین | یک ماده مرکب خالص ، عناصر یکسان با نسبتهای جرمی یکسان دارد. | law of definite propotions |
| قانون پایستاری | جرم در جریان واکنش شیمیایی ، تغییر قابل توجهی نمیکند. | Law of conservation of mass |
| انرژی | ظرفیت انجام دادن کار | Energy |
| دما | درجه داغی یا سردی ، خاصیتی که جهت جریان یافتن خود به خود گرما را معین میکند. | temperature |
| ظرفیت گرمایی | مقدار گرمای لازمی است که دمای جرم معینی را یک درجه سانتیگراد بالا میبرد. | Heat capocity |
| گرما | شکلی از انرژی است که بهطور خودبخود از جسمی با دمای زیادتر به جسمی با دمای کمتر جریان مییابد. | Heat |
| گرماسنج | دستگاهی که برای اندازه گیری گرمای انتقال یافته در واکنشهای شیمیایی و تغییرات فیزیکی بکار میرود. | Calorimeter |
| گرماشیمی | مطالعه تغییرات انرژی که همراه با تغییرات شیمایی و فیزیکی است. | thermochemistry |
| گرمای ویژه | مقدار گرمای لازمی که دمای ۱gr ماده خالص را یک درجه سانتیگراد بالا میبرد. | specific heat |
| مقیاس دمای سلسیوس | یک مقیاس دمایی براساس تخصیص صفر درجه سانتیگراد به نقطه انجماد عادی آب و ْ۱۰۰ سانتیگراد به نقطه جوش عادی آب است. | Celsius temperature scale |
| مقیاس دمای فارنهایت | نوعی مقیاس دمایی است که در آن ، نقطه انجماد عادی آب ، ْ۳۲فارنهایت و نقطه جوش عادی آب ْ۲۱۲فارنهایت است | Fahrenheit temperature scale |
| مقیاس دمای کلوین | یک مقیاس دمایی براساس تخصیص ۲۷۳k به نقطه انجماد عادی آب و ۳۷۳k به نقطه جوش عادی آب | Kelvin tempratire scale |
| اصل عدم قطعیت | تعیین همزمان موقعیت دقیق و حرکت یا تکانه (جرم در سرعت mv) دقیق یک الکترون ، ناممکن است. | uncertainty principle |
| تابش الکترومغناطیسی | انرژی تابشی که با سرعت خاصی (سرعت نور ، c) حرکت میکند و میتوان آن را بهصورت موجی یا کوانتومی توصیف کرد. | Electromagnetic radiation |
| عدد کوانتومی اصلی | عدد کوانتومی که پوسته انرژی الکترون مربوط را نشان میدهد. مقادیر n اعداد صحیح مثبت …و۳و۲و۱ است. | main quantum number |
| عدد کوانتومی فرعی | عدد کوانتومی که نوع پوسته فرعی و شکل اوربیتال الکترونهای مربوط را تعیین میکند. | Sub sidiary |
| عدد کوانتومی مغناطیسی | عدد کوانتومی که جهت گیری اوربیتال الکترونی را تعیین میکند. | magnetic quantum number |
| فوتون | یک کوانتوم انرژی تابشی | photon |
| کوانتوم | مقدار کوچک و معین انرژی تابشی. نظریه پلانک براین اساس است که انرژی تابش ، در این مقادیر جذب یا نشر می شود. انرژی یک کوانتوم ، E ، مستقیما با فرکانس تابش ، v ، متناسب است و ثابت تناسب ، h ، ثابت پلانک است. | quantum |
| آنتالپی تصعید | تغییر آنتالپی مربوط به فرآیندی که در آن ، یک جامد مستقیما به گاز تبدیل میشود. | Enthalpy of sublimation |
| چرخه بورن هابر | روش تحلیلی برای تغییرات آنتالپی یک فرآیند. H∆ کل فرآیند را با جمع جبری مقادیر H∆ مجموعه مراحلی که به همان نوع تغییر میانجامد، برابر میگیرند. | Born-Haber cycle |
| اتمسفر | واحد فشار که به صورت ۱۰۱۳۲۵Pa بیان میشود. | atmosphere |
| اصل آووگادرو | حجمهای مساوی از تمام گازها ، در دما و فشار یکسان ، دارای عده مولکولهای مساویاند. | Avogadro,s principle |
| پاسکال | واحد فشار در دستگاه SI و آن برابر با نیرویی است که یک نیوتن (یا ۱kg.m.s۲) بر سطح یک متر مربع وارد میکند. | Pascal |
| تور | واحد فشار که همارز با فشاری است که ستونی از جیوه را در ارتفاع ۱mm نگه میدارد. یک تور برابر ۷۶۰.۱ اتمسفر است. | torr |
| توزیع ماکسول- بولتسمان | نحوه توزیع انرژی جنبشی یا سرعت مولکولی بین مولکولهای یک گاز | Maxwell- Bultzman |
| ثابت گازهای ایدهآل | ضریب تناسب در معادله حالت یک گار ایدهآل و یکی از مقادیر ۰.۰۸۲۰۵۶L.atm/K.md است. | Ideal gas constant |
| جذر میانگین مجذور سرعت | جذر میانگین مجذور سرعتهای مولکولی | root-mean-square speed |
| حجم مولی استاندارد | حجم یک مول از گاز در دما و فشار استاندار که ۲۲.۴۱۴L است. | standard molecular volume |
| دمای بحرانی | دمایی است که بالاتر از آن ، هرچند هم که فشار زیاد شود، مایع شدن گاز ناهمگن است. | Critical temprature |
| ضریب تراکم پذیری | PV/RT که در آن ، P فشار گاز ، V حجم گاز ، R ثابت گازهای ایده آل و T دمای مطلق است. ضریب تراکم پذیری برای یک مول از گاز ایدهآل همواره برابر واحد است. | Conversion factor |
| فشار | نیرویی است که بر واحد سطح وارد میشود. | Pressure |
| فشار بحرانی | فشار لازم برای مایع شدن یک گاز در دمای بحرانی آن | Critical pressure |
| فشار جزیی | فشاری که یک جزء از یک مخلوط گازی اگر به تنهایی در حجم مورد نظر میبود، اعمال میکرد. | Partial pressure |
| قانون آمونتون | فشار یک گاز ، در حجم ثابت ، بهطور مستقیم با دما تغییر میکند. | Amonton,s Law |
| قانون بویل | حجم یک گاز در دمای ثابت به نسبت عکس فشار تغییر میکند. | Boyle ,s law |
| قانون ترکیب حجمی گیلوساک | حجم گازهای مصرف شده یا تولید شده در یک واکنش شیمیایی ، اگر در دما و فشار ثابت اندازه گیری شده باشند، با نسبتهای اعداد صحیح کوچک بیان میشود. | Gay-Lussac,s low of combining |
| قانون شارل | حجم یک گاز ، در فشار ثابت ، بهطور مستقیم با دمای مطلق تغییر میکند. | charles Law |
| قانون فشارهای جزیی دالتون | فشار کل مخلوطی از گازها برابر مجموع فشارهای جزیی هر یک از گازها است. | Dalton,s Law of partial pressure |
| قانون نفوذ گراهام | سرعت نفوذ یک گاز با جذر چگالی یا جذر وزن مولکول آن گاز نسبت معکوس دارد. | Graham,s Law of effusion |
| کسر مولی | نسبت تعداد مولهای یک جزء در یک مخلوط به تعداد کل مولها در آن مخلوط | mole fraction |
| مسافت آزاد میانگین | فاصله میانگینی است که یک مولکول بین برخوردهای خود با سایر مولکولهای گاز طی میکند. | mean free path |
| معادله واندروالس | معادله حالت گازها. نوعی از معادله حالت گاز ایدهآل که نیروهای جاذبه بین مولکولی و حجم اشغال شده توسط مولکولهای گاز را به حساب میآورد. | Vander wool,s equation |
| نظریه جنبشی گازها | مدلی است در سطح مولکولی که میتوان آن را برای توضیح قوانین گازها بکار برد و معادله گاز ایده آل را بدست آورد. | Kinetic theory of gases |
| آنتالپی تبخیر | انرژی لازم برای تبخیر مقدار معینی مایع (معمولا یک مول یا یک گرم) در دمای معین | Enthalpy of vaprization |
| آنتالپی تبلور | تغییر آنتالپی در تبدیل مقدار معینی مایع (معمولا یک مول یا یک گرم) به جامد در دمای معین | Enthalpy of crystllization |
| آنتالپی ذوب | انرژی لازم برای ذوب کردن مقدار معینی جامد (معمولا یک مول یا یک گرم) بر جامد در دمای معین | Enthalpy of fusion |
| آنتالپی میعان | تغییر آنتالپی در تبدیل مقدار معینی گاز (معمولا یک مول یا یک گرم) در دمای معین | Enthalpy of condenstion |
| تبخیر | فرآیند تبدیل مایع به گاز | Vaporization |
| تصعید | فرآیند تبدیل مستقیم جامد به گاز بدون عبور از حالت مایع | Sublimation |
| تعادل | شرایطی که در آن ، سرعت دو تمایل مخالف برابر میشوند. | equilibrium |
| فشار بخار | فشار بخار در حالت تعادل با مایع خالص یا جامد خالص در دمای معین | vapour pressure |
| معادله کلازیوس- کلاپیرون | معادله ای است که فشار بخار یک مایع در دو دمای مختلف را با یکدیگر و با آنتالپی تبخیر آن مایع مرتبط میسازد | Clausius- Clapeyron equation |
| نقطه انجماد | دمایی که در آن ، فازهای جامد و مایع با یکدیگر در حال تعادلند. اگر فشار کل ، ۱atm باشد، این مقدار را انجماد عادی مینامیم. | Solidify point |
| نقطه جوش | نقطه جوش یک مایع ، عبارت از دمایی است که در آن ، فشار بخار مایع با فشار بیرونی برابر میشود و نقطه جوش عادی یک مایع ، دمایی است که در آن ، فشار بخار مایع برابر ۱atm است. | boiling point |
| نقطه ذوب | مراجعه کنید به نقطه انجماد | melting point |
| نقطه سه گانه | دما و فشاری که در آن ، حالات جامد ، مایع و گاز یک ماده در عین حال با یکدیگر در حال تعادلاند. | triple point |
| آبپوشی | فرایندی است که آن ، مولکولهای آب به سوی ذرات ماده حل شده جذب میشوند و آنها را احاطه میکنند. | Hydration |
| آزیوتروپ | محلولی است که فشار بخار آن ، بالاتر یا پایینتر از فشار بخار هر یک از اجرای خالص است. اگر فشار بخار بالاتر باشد، آن محلول ، آزیوتروپ با نقطه جوش مینیمم و اگر پایینتر باشد، آزیوتروپ با نقطه جوش ماکزیمم است. | Azeotrope |
| آنتالپی آبپوشی | تغییر آنتالپی مربوط به فرآیند آبپوشی یونهای گازی از مقدار معینی (معمولا یک مول) از یک ماده حل شده است. | Enthalpy of hydration |
| آنتالپی انحلال | تغییر آنتالپی مربوط به فرآیند انحلال مقدار معینی (معمولا یک مول) از یک حل شونده در یک حلال است. مقدار این آنتالپی به دما و غلظت نهایی محلول بستگی دارد. | Enthalpy of solution |
| اسمز | فرآیند عبور مولکولهای حلال از غشای نیمتراوایی است که دو محلول را از یکدیگر جدا میکند. جهت عبور این مولکولها به سوی محلول غلیظتر است. | Osmosis |
| اصل لوشاتلیه | هر سیستم در حالت تعادل نسبت به تغییر شرایط ، عکسالعمل نشان داده، در جهت مقابله با آن عمل میکند. | Le,chatelier,s priciple |
| تقطیر | جداسازی اجزای سازنده یک محلول با روش تبخیر و تراکم است. | Distillation |
| خواص غلظتی | خواصی از یک محلول است که به غلظت ذرات ، نه به ماهیت این ذرات ، بستگی دارند. این خواص ، عبارتند از کاهش بخار ، نزول نقطه انجماد ، صعود نقطه جوش و فشار اسمزی | Colligalive properties |
| ضریب وانت- هوف | عبارت از نسبت مقدار خاصیت غلظتی اندازه گیری شده یک محلول به مقدار محاسبه شده آن خاصیت است، به فرض اینکه ماده حل شده غیر الکترولیت باشد. | Van,t Hoff factor |
| قانون رایول | فشار جزیی هر جزء از یک محلول ایده آل در بخار آن محلول برابر با حاصلضرب فشار بخار آن جزء به صورت خالص در کسر مولی آن جزء در محلول است. | Rault,s Law |
| قانون هنری | وقتی که یک گاز در یک مایع بدون واکنش شیمیایی حل میشود، مقدار گاز حل شده در مقدار معینی از مایع با فشار جزیی آن گاز در بالای محلول نسبت مستقیم دارد. | Hanry,s Law |
| محلول ایده آل | محلولی است که از قانون رایول پیروی میکند. یک محلول دو جزیی متشکل از B,A وقتی ایده آل است که در آن ، نیروهای بین مولکولی مولکولهای B,A و مولکولهای A,A و مولکولهای B,B اساسا یکسانند. |
طیف سنجی جرمی
تاریخچه
اصول طیف سنجی جرمی ، جلوتر از هر یک از تکنیکهای دستگاهی دیگر ، بنا نهاده شده است. تاریخ پایه گذاری اصول اساسی آن به سال 1898 بر میگردد. در سال 1911 ، "تامسون" برای تشریح وجود نئون-22 در نمونهای از نئون-20 از طیف جرمی استفاده نمود و ثابت کرد که عناصر میتوانند ایزوتوپ داشته باشند. تا جایی که میدانیم، قدیمیترین طیف سنج جرمی در سال 1918 ساخته شد.
اما روش طیف سنجی جرمی تا همین اواخر که دستگاههای دقیق ارزانی در دسترس قرار گرفتند، هنوز مورد استفاده چندانی نداشت. این تکنیک با پیدایش دستگاههای تجاری که بسادگی تعمیر و نگهداری میشوند و با توجه به مناسب بودن قیمت آنها برای بیشتر آزمایشگاههای صنعتی و آموزشی و نیز بالا بودن قدرت تجزیه و تفکیک ، در مطالعه تعیین ساختمان ترکیبات از اهمیت بسیاری برخوردار گشته است.
اصول طیف سنجی جرمی 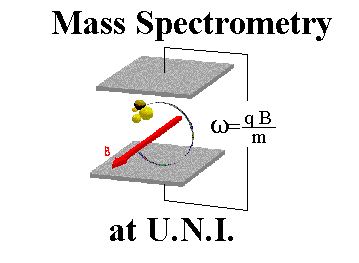
به بیان ساده ، طیف سنج جرمی سه عمل اساسی را انجام میدهد:
مولکولها توسط جرایاناتی از الکترونهای پرانرژی بمباران شده و بعضی از مولکولها به یونهای مربوطه تبدیل میگردند. سپس یونها در یک میدان الکتریکی شتاب داده میشوند.
یونهای شتاب داده شده بسته به نسبت بار/جرم آنها در یک میدان مغناطیسی یا الکتریکی جدا میگردند.
یونهای دارای نسبت بار/جرم مشخص و معین توسط بخشی از دستگاه که در اثر برخورد یونها به آن ، قادر به شمارش آنها است، آشکار میگردند. نتایج داده شده خروجی توسط آشکار کننده بزرگ شده و به ثبات داده میشوند. علامت یا نقشی که از ثبات حاصل میگردد یک طیف جرمی است، نموداری از تعداد ذرات آشکار شده بر حسب تابعی از نسبت بار/جرم.
دستگاه طیف سنج جرمی
هنگامی که هر یک از عملیات را بدقت مورد بررسی قرار دهیم، خواهیم دید که طیف سنج جرمی واقعا پیچیدهتر از آن چیزی است که در بالا شرح داده شد.
سیستم ورودی نمونه
قبل از تشکیل یونها باید راهی پیدا کرد تا بتوان جریانی از مولکولها را به محفظه یونیزاسیون که عمل یونیزه شدن در آن انجام میگیرد، روانه ساخت. یک سیستم ورودی نمونه برای ایجاد چنین جریانی از مولکولها بکار برده میشود. نمونههایی که با طیف سنجی جرمی مورد مطالعه قرار میگیرند، میتوانند به حالت گاز ، مایع یا جامد باشند. در این روش باید از وسایلی استفاده کرد تا مقدار کافی از نمونه را به حالت بخار در آورده ، سپس جریانی از مولکولها روانه محفظه یونیزاسیون شوند.
در مورد گازها ، ماده ، خود به حالت بخار وجود دارد. پس ، از سیستم ورودی سادهای میتوان استفاده کرد. این سیستم تحت خلاء بوده، بطوری که محفظه یونیزاسیون در فشاری پایینتر از سیستم ورودی نمونه قرار دارد.
روزنه مولکولی
نمونه به انبار بزرگتری رفته که از آن ، مولکولهای بخار به محفظه یونیزاسیون میروند. برای اطمینان از اینکه جریان یکنواختی از مولکولها به محفظه یونیزاسیون وارد میشود، قبل از ورود ، بخار از میان سوراخ کوچکی که "روزنه مولکولی" خوانده میشود، عبور میکند. همین سیستم برای مایعات و جامدات فرار نیز بکار برده میشود. برای مواد با فراریت کم ، میتوان سیستم را به گونهای طراحی کرد که در یک اجاق یا تنور قرار گیرد تا در اثر گرم کردن نمونه ، فشار بخار بیشتری حاصل گردد. باید مراقب بود که حرارت زیاد باعث تخریب ماده نگردد.
در مورد مواد جامد نسبتا غیر فرار ، روش مستقیمی را میتوان بکار برد. نمونه در نوک میلهای قرار داده میشود و سپس از یک شیر خلاء ، وارد محفظه یونیزاسیون میگردد. نمونه در فاصله بسیار نزدیکی از پرتو یونیزه کننده الکترونها قرار میگیرد. سپس آن میله ، گرم شده و تولید بخاری از نمونه را کرده تا در مجاورت پرتو الکترونها بیرون رانده شوند. چنین سیستمی را میتوان برای مطالعه نمونهای از مولکولهایی که فشار بخار آنها در درجه حرارت اتاق کمتر از 9 - 10 میلیمتر جیوه است، بکار برد.
محفظه یونیزاسیون
هنگامی که جریان مولکولهای نمونه وارد محفظه یونیزاسیون گشت ، توسط پرتوی از الکترونهای پرانرژی بمباران میشود. در این فرآیند ، مولکولها به یونهای مربوطه تبدیل گشته و سپس در یک میدان الکتریکی شتاب داده میشوند. در محفظه یونیزاسیون پرتو الکترونهای پرانرژی از یک "سیم باریک" گرم شده ساطع میشوند. این سیم باریک تا چند هزار درجه سلسیوس گرم میشود. به هنگام کار در شرایطی معمولی ، الکترونها دارای انرژی معادل 70 میکرون - ولت هستند.
این الکترونهای پرانرژی با مولکولهایی که از سیستم نمونه وارد شدهاند، برخورد کرده و با برداشتن الکترون از آن مولکولها ، آنها را یونیزه کرده و به یونهای مثبت تبدیل میکنند. یک "صفحه دافع" که پتانسیل الکتریکی مثبتی دارد، یونهای جدید را به طرف دستهای از "صفحات شتاب دهنده" هدایت میکند. اختلاف پتانسیل زیادی (حدود 1 تا 10 کیلو ولت) از این صفحات شتاب دهنده عبور داده میشود که این عمل ، پرتوی از یونهای مثبت سریع را تولید میکند. این یونها توسط یک یا چند "شکاف متمرکز کننده" به طرف یک پرتو یکنواخت هدایت میشوند.
بسیاری از مولکولهای نمونه به هیچ وجه یونیزه نمیشوند. این مولکولها بطور مداوم توسط مکندهها یا پمپهای خلا که به محفظه یونیزاسیون متصل نیستند، خارج میگردند. بعضی از این مولکولها از طریق جذب الکترون به یونهای منفی تبدیل میشوند. این یونهای منفی توسط صفحه دافع جذب میگردند. ممکن است که بخش کوچکی از یونهای تشکیل شده بیش از یک بار داشته باشند، (از دست دادن بیش از یک الکترون) اینها مانند یونهای مثبت تک ظرفیتی ، شتاب داده میشوند.
پتانسیل یونیزاسیون
انرژی لازم برای برداشتن یک الکترون از یک اتم یا مولکول ، پتانسیل یونیزاسیون آن است. بسیاری از ترکیبات آلی دارای پتانسیل یونیزاسیونی بین 8 تا 15 الکترون ولت هستند. اما اگر پرتو الکترونهایی که به مولکولها برخورد میکند، پتانسیلی معادل 50 تا 70 الکترون ولت نداشته باشد، قادر به ایجاد یونهای زیادی نخواهد بود. برای ایجاد یک طیف جرمی ، الکترونهایی با این میزان انرژی برای یونیزه کردن نمونه بکار برده میشوند.
تجزیه گر جرمی
پس از گذر کردن از محفظه یونیزاسیون ، پرتو یونها از درون یک ناحیه کوتاه فاقد میدان عبور میکند. سپس آن پرتو ، وارد "تجزیه گر جرمی" شده که در آنجا ، یونها بر حسب نسبت بار/جرم آنها جدا میشوند. انرژی جنبشی یک یون شتاب داده شده برابر است با:
12mv2=ev
که m جرم یون ، v سرعت یون ، e بار یون و V اختلاف پتانسیل صفحات شتاب دهنده یون است.
در حضور یک میدان مغناطیسی ، یک ذره باردار مسیر منحنی شکلی را خواهد داشت. معادلهای که شعاع این مسیر منحنی شکل را نشان میدهد به صورت زیر است:
(r =MV)/eH
که r شعاع انحنای مسیر و H قدرت میدان مغناطیسی است.
اگر این دو معادله را برای حذف عبارت سرعت ترکیب کنیم، خواهیم داشت:
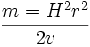
این معادله مهمی است که رفتار و عمل یک یون را در بخش تجزیهگر جرمی یک طیف سنج جرمی توجیه میکند.
طیف سنج جرمی
تجزیه گر جرمی و قدرت تفکیک 
از معادله فوق چنین بر میآید که هر قدر ، مقدار m/e بزرگتر باشد، شعاع انحنای مسیر نیز بزرگتر خواهد بود. لوله تجزیهگر دستگاه طوری ساخته شده است که دارای شعاع انحنای ثابتی است. ذرهای که نسبت m/e صحیحی داشته باشد، قادر خواهد بود تا طول لوله تجزیهگر منحنی شکل را طی کرده ، به آشکار کننده نمیرسند. مسلما اگر دستگاه ، یونهایی را که جرم بخصوصی دارند، نشان دهد. این روش چندان جالب نخواهد بود.
بنابراین بطور مداوم ، ولتاژ شتاب دهنده یا قدرت میدان مغناطیسی تغییر یافته تا بتوان کلیه یونهایی که در محفظه یونیزاسیون تولید گشتهاند را آشکار ساخت. اثری که از آشکار کننده حاصل میگردد، بصورت طرحی است که تعداد یونها را بر حسب مقدار m/e آنها رسم میکند. فاکتور مهمی که باید در یک طیف سنج جرمی در نظر گرفتن قدرت تفکیک آن است. قدرت تفکیک بر طبق رابطه زیر تعریف میشود:
(R=M)/M
که R قدرت تفکیک ، M جرم ذره و M∆ اختلاف جرم بین یک ذره با جرم M و ذره بعدی با جرم بیشتر است که میتواند توسط دستگاه تفکیک گردد. دستگاههایی که قدرت تفکیک ضعیفی دارند، مقدار R آنها حداکثر 2000 در بعضی مواقع قدرت تفکیکی به میزان پنج تا ده برابر مقدار فوق مورد نیاز است.
آشکار کننده
آشکار کننده بسیاری از دستگاهها ، شامل یک شمارشگر است که جریان تولیدی آن متناسب با تعداد یونهایی است که به آن برخورد میکند. با استفاده از مدارهای الکترون افزاینده میتوان آن قدر دقیق این جریان را اندازه گرفت که جریان حاصل از برخورد فقط یک یون به آشکار کننده اندازه گیری شود.
ثبات آشکار کننده
سیگنال تولید شده از آشکار کننده به یک ثبات داده میشود که این ثبات خود طیف جرمی را ایجاد مینماید. در دستگاههای جدید ، خروجی آشکار کننده از طریق یک سطح مشترک به رایانه متصل است. رایانه قادر به ذخیره اطلاعات بوده و خروجی را به هر دو صورت جدولی و گرافیکی در میآورد. دست آخر دادهها با طیفهای استاندارد ذخیره شده موجود در رایانه مقایسه میگردد.
در دستگاهها قدیمیتر ، جریان الکترونی حاصل از آشکار کننده به یک سری از پنج گالوانومتر با حساسیتهای متفاوت داده میشود. پرتو نوری که به آینههای متصل به گالوانومترها برخورد میکند و به یک صفحه حساس به نور منعکس میگردد. بدین طریق یک طیف جرمی با پنج نقش بطور همزمان ، هر یک با حساسیتی متفاوت ایجاد میگردد. در حالی که هنوز دستگاه قویترین قلهها را در صفحه طیف نگاه میدارد، با استفاده از این پنج نقش ثبت ضعیفترین قلهها نیز ممکن میگردد.
دانشجویان عزیز
کلاس جبرانی شما روزهای پنج شنبه 31فروردین ساعت 10-13 کلاس 418و روز جمعه 1اردیبهشت ساعت 9-12 دانشکده علوم پایه تشکیل میشود.
حضور شما در یکی از این کلاس ها اجباری است.
موفق باشید
بسم الله الرحمن الرحیم
نگاه اجمالی
در ترمودینامیک فقط با متغیرهای ماکروسکوپیک ، مانند فشار و دما و حجم سر و کار داریم. قوانین اصلی ترمودینامیکها بر حسب چنین کمیتهایی بیان میشوند. ابدا درباره این امر که ماده از اتمها ساخته شده است صحبتی نمیکنند. لیکن مکانیک آماری ، که با همان حیطهای از علم سر و کار دارد که ترمودینامیک از آن بحث میکند و وجود اتمها را از پیش مفروض میداند. قوانین اصلی مکانیک آماری حامی قوانین مکانیکاند که در حدود اتمهای تشکیل دهنده سیسنم بکار میروند.
تاریخچه
نظریه جنبشی توسط رابرت بویل (Rabert Boyle) (1627 – 1691) ، دانیل برنولی (1700 – 1782) ، جیمز ژول (1818 – 1889) ، کرونیگ (1822 – 1874) ، رودولف کلاوسیوس (1822 – 1888) و کلرک ماکسول ( 1831 – 1879 ) و عدهای دیگر تکوین یافته است. در اینجا نظریه جنبشی را فقط در مورد گازها بکار میبریم، زیرا برهم کنشهای بین اتمها ، در گازها به مراتب متغیرترند تا در مایعات. و این امر مشکلات ریاضی را خیلی آسانتر میکند.
در سطح دیگر میتوان قوانین مکانیک را بطور آماری و با استفاده از روشهایی که صوریتر و انتزاعیتر از روشهای نظریه جنبشی هستند بکار برد. این رهیافت که توسط جی ویلارد گیبس (J.willard Gibbs) و لودویگ بولتز مانی (Ludwig Boltz manni) (1844 – 1906) و دیگران تکامل یافته است، مکانیک آماری نامیده میشود، که نظریه جنبشی را به عنوان یکی از شاخههای فرعی در بر میگیرد. با استفاده از این روشها میتوان قوانین ترمودینامیک را به دست آورد. بدین ترتیب معلوم میشود که ترمودینامیک شاخهای از علم مکانیک است.
|
|
محاسبه فشار بر پایه نظریه جنبشی
فشار یک گاز ایدهآل را با استفاده از نظریه جنبشی محاسبه میکنند. برای ساده کردن مطلب ، گازی را در یک ظرف مکعب شکل با دیوارههای کاملا کشسان در نظر میگیریم. فرض میکنیم طول هر ضلع مکعب L باشد. سطحهای عمود بر محور X را که مساحت هر کدام e2 است. A1 و A2 مینامیم. مولکولی را در نظر میگیریم که دارای سرعت V باشد. سرعت V را میتوان در راستای یالهای مولفههای Vx و Vy و Vz تجزیه کرد.
اگر این ذره با A1 برخورد کند در بازگشت مولفه X سرعت آن معکوس می شود. این برخورد اثری رو ی مولفه Vy و یا Vy ندارد در نتیجه متغیر اندازه حرکت عبارت خواهد بود :
m Vx - m Vx) = 2 m Vx -) = اندازه حرکت اولیه – اندازه حرکت نهایی
که بر A1 عمود است. بنابراین اندازه حرکتی e به A1 داده میشود برابر با m Vx2 خواهد بود زیرا اندازه حرکت کل پایسته است.
زمان لازم برای طی کردن مکعب برابر خواهد بود با Vx/L. در A2 دوباره مولفه y سرعت معکوس میشود و ذره به طرف A1 باز میگردد. با این فرض که در این میان برخوردی صورت نمیگیرد مدت رفت و برگشت برابر با 2 e Vx خواهد بود. به طوری که آهنگ انتقال اندازه حرکت از ذره به A1 عبارت است:
mVx2/e = Vx/2e . 2 mVx ، برای به دست آوردن نیروی کل وارد بر سطح A1 ، یعنی آهنگ انتقال اندازه حرکتی از طرف تمام مولکولهای گاز به A1 داده میشود.
(P = M/e(Vx12 + Vx22 + Vx32
P = 1/2eV2
|
|
تعبیر دما از دیدگاه نظریه جنبشی
با توجه به فرمول RT 2/3 = 1/2 MV2 یعنی انرژی کل انتقال هر مول از مولکولهای یک گاز ایدهآل ، با دما متناسب است. میتوان گفت که این نتیجه با توجه به معادله بالا برای جور در آمدن نظریه جنبشی با معادله حالت یک گاز ایدهآل لازم است. و یا اینکه میتوان معادله بالا را به عنوان تعریفی از دما بر پایه نظریه جنبشی یا بر مبنای میکروسکوبیک در نظر گرفت. هر دو مورد بینشی از مفهوم دمای گاز به ما میدهد. دمای یک گاز مربوط است به انرژی جنبشی انتقال کل نسبت به مرکز جرم گاز اندازه گیری میشود. انرژی جنبشی مربوط به حرکت مرکز جرم گاز ربطی به دمای گاز ندارد.
حرکت کاتورهای را به عنوان بخشی از تعریف آماری یک گاز ایدهآل در نظر گرفت. V2 را بر این اساس میتوان محاسبه کرد. در یک توزیع کاتورهای سرعتهای مولکولی ، مرکز جرم در حال سکون خواهد بود. بنابراین ما باید چارچوب مرجعی را بکار ببریم که در آن مرکز جرم گاز در حال سکون باشد. در چارچوبهای دیگر ، سرعت هر یک از مولکولها به اندازه U (سرعت مرکز جرم در آن چارچوب) از سرعت آنها در چارچوب مرکز جرم بیشتر است. در اینصورت حرکتها دیگر کترهای نخواهد بود و برای V2 مقادیر متفاوتی بدست میآید. پس دمای گاز داخل یک ظرف در یک قطار متحرک افزایش مییابد. میدانیم که M V2 1/2 میانگین انرژی جنبشی انتقالی هر مولکول است. این کمیت در یک دمای معین که در این مورد صفر درجه سلسیوس است، برای همه گازها مقدار تقریبا یکسانی دارد. پس نتیجه میگیریم که در دمای T ، نسبت جذر میانگین مربعی سرعتهای مولکولهای دو گاز مختلف مساوی است با ریشه دمای عکس نسبت به مربعهای آنها.
T = 2/3k m1 V12/2= 2/3k m2 V22/2
|
|
مسافت آزاد میانگین
در فاصله برخوردهای پیدرپی ، هر مولکول از گاز با سرعت ثابتی در طول یک خط راست حرکت میکند. فاصله متوسط بین این برخوردهای پیدرپی را مسافت آزاد میانگین مینامند. اگر مولکولها به شکل نقطه بودند، اصلا با هم برخورد نمیکردند. و مسافت آزاد میانگین بینهایت میشد. اما مولکولها نقطهای نیستند و بدین جهت برخوردهایی روی میدهد. اگر تعداد مولکولها آنقدر زیاد بود که میتوانستند فضایی را که در اختیار دارند کاملا پر کنند و دیگر جایی برای حرکت انتقالی آنها باقی نمیماند. آن وقت مسافت آزاد میانگین صفر میشد.
بنابراین مسافت آزاد میانگین بستگی دارد به اندازه مولکولها و تعداد واحد آنها در واحد حجم. و به قطر d و مولکولهای گاز به صورت کروی هستند در این صورت مقطع برای برخورد برابر با лd2 خواهد بود.
مولکولی با قطر 2d را در نظر میگیریم که با سرعت V در داخل گازی از ذرات نقطهای هم ارز حرکت میکند. این مولکول در مدت t استوانهای با سطح مقطع лd2 و طول Vt را میروبد. اگر nv تعداد مولکولها در واحد حجم باشد استوانه شامل (лd2 Vt ) nv ذره خواهد بود. مسافت آزاد میانگین ، L ، فاصله متوسط بین دو برخورد پیدرپی است بنابراین ، L ، عبارت است از کل مسافتی که مولکول در مدت t میپیماید. (Vt) تقسیم بر تعداد برخوردهایی که در این مدت انجام میدهد. یعنی:
I = Vt/πd2nv =1/√2πnd2
I = 1/√2πnd2
این میانگین بر مبنای تصویری است که در آن یک مولکول با هدفهای ساکن برخورد میکند. در واقع ، برخوردهای مولکول با هدف دمای متحرک انجام میگیرد در نتیجه تعداد برخورد دما از این مقدار بیشتر است.
توزیع سرعتهای مولکولی
با توجه به سرعت جذر میانگین مربعی مولکولهای گاز ، اما گستره سرعتهای تکتک مولکولها بسیار وسیع است. بطوری که برای هر گازی منحنیای از سرعتها مولکولی وجود دارد که به دما وابسته است. اگر سرعتهای تمام مولکولهای یک گاز یکسان باشند این وضعیت نمیتواند مدت زیاد دوام بیاورد. زیرا سرعتهای مولکولی به علت برخوردها تغییر خواهند کرد. با وجود این انتظار نداریم که سرعت تعداد زیادی از مولکولها بسیار کمتر از Vrms (یعنی نزدیک صفر) یا بسیار بیشتر از Vrms ، زیرا وجود چنین سرعتهایی مستلزم آن است که یک رشته برخوردهایی نامحتمل و موجی صورت بگیرد. مسئله محتملترین توزیع سرعتها در مورد تعداد زیادی از مولکولهای یک گاز را ابتدا کلوک ماکسول حل کرد. قانونی که او ارائه کرد در مورد نمونهای از گاز که N مولکول را شامل میشد چنین است :
N(V) = 4πN(m/2πKt)3/2V2e-mv2/2kt
در این معادله N(V)dV تعداد مولکولهایی است که سرعت بین V و V+3v است، T دمای مطلق ، K ثابت بولتزمن ، m جرم هر مولکول است. تعداد کل مولکولهای گاز (N) را ، با جمع کردن (یعنی انتگرالگیری) تعداد موجود در هر بازه دیفرانسیلی سرعت از صفر تا بینهایت به دست میآید. واحد (N(V میتواند مثلا مولکول برا سانتیمتر بر ثانیه باشد.
N =∫∞0N(V)dv
توزیع سرعتهای مولکولی در مایعات
توزیع سرعتهای مولکولی در مایعات شبیه گاز است. اما بعضی از مولکولهای مایع (آنهایی که سریعترند) میتوانند در دماهایی کاملا پایینتر از نقطه جوش عادی از سطح مایع بگریزند. (یعنی تبخیر شوند). فقط این مولکولها هستند که میتوانند بر جاذبه مولکولهای سطح فائق آیند. و در اثر تبخیر فرار کنند. بنابراین انرژی جنبشی میانگین مولکولهای باقیمانده نیز کاهش مییابد در نتیجه دمای مایع پایین میآید. این امر روشن میکند که چرا تبخیر فرایند سرمایشی است.
دانشجویان علوم و تحقیقات موفق به کسب رتبه اول المپیاد نفت در خاورمیانه شدند.
دانشجویان واحد علوم و تحقیقات دانشگاه آزاد اسلامی در المپیاد نفت انجمن بین المللی مهندسان نفت (SPE) سال 2011- 2012 ، رتبه های اول در ایران و خاورمیانه را کسب کردند
به گزارش روابط عمومی واحد علوم و تحقیقات انجمن بین المللی مهندسان نفت (SPE) اقدام به برگزاری المپیاد نفت در سه مقطع کارشناسی ، کارشناسی ارشد و دکتری در ایران کرده است و آقایان بهادر وکیلی دانشجوی کارشناسی و رضا کشاورزی دانشجوی کارشناسی ارشد مهندسی نفت این واحد موفق به کسب رتبه های برتر در سطح خاورمیانه شدند.
بر اساس این گزارش شرکت کنندگان المپیاد نفت در مقاطع کارشناسی ، کارشناسی ارشد و دکتری در سطح کشوری از دانشگاه های شریف ، تهران ، علم و صنعت ، صنعت نفت و واحد علوم و تحقیقات بودند که از میان این شرکت کنندگان ، دانشجویان واحد علوم و تحقیقات رتبه های برتر در سطح ملی را کسب کردند . همچنین دور دوم این المپیاد در کشور امارات با حضور رتبه های برتر کشورهای ایران ، هند ، مصر ، عربستان ، قطر ، پاکستان ، عمان ، امارات و بحرین و با حضور 7 داور بین المللی از خاورمیانه ، آفریقا ، اروپا و آسیای شرقی برگزار شد و دانشجویان واحد علوم و تحقیقات در مقاطع کارشناسی و کارشناسی ارشد این مسابقات نیز رتبه های برتر در سطح خاورمیانه را کسب کردند.
همچنین نفرات برتر این المپیاد در خاورمیانه آذرماه سال جاری به مسابقات جهانی (SPE) در آمریکا اعزام خواهند شد.
لازم به ذکر است مسابقات بین المللی مهندسی نفت SPE ، بزرگترین و مطرح ترین المپیاد رقابتی و پژوهشی مهندسی نفت در دنیا بوده و به زبان انگلیسی است و در حضور روسای شرکت های بزرگ نفتی و ریاست کل SPE از آمریکا برگزار می شود.
بسم الله الرحمن الرحیم
نگاه اجمالی
در ترمودینامیک فقط با متغیرهای ماکروسکوپیک ، مانند فشار و دما و حجم سر و کار داریم. قوانین اصلی ترمودینامیکها بر حسب چنین کمیتهایی بیان میشوند. ابدا درباره این امر که ماده از اتمها ساخته شده است صحبتی نمیکنند. لیکن مکانیک آماری ، که با همان حیطهای از علم سر و کار دارد که ترمودینامیک از آن بحث میکند و وجود اتمها را از پیش مفروض میداند. قوانین اصلی مکانیک آماری حامی قوانین مکانیکاند که در حدود اتمهای تشکیل دهنده سیسنم بکار میروند.
تاریخچه
نظریه جنبشی توسط رابرت بویل (Rabert Boyle) (1627 – 1691) ، دانیل برنولی (1700 – 1782) ، جیمز ژول (1818 – 1889) ، کرونیگ (1822 – 1874) ، رودولف کلاوسیوس (1822 – 1888) و کلرک ماکسول ( 1831 – 1879 ) و عدهای دیگر تکوین یافته است. در اینجا نظریه جنبشی را فقط در مورد گازها بکار میبریم، زیرا برهم کنشهای بین اتمها ، در گازها به مراتب متغیرترند تا در مایعات. و این امر مشکلات ریاضی را خیلی آسانتر میکند.
در سطح دیگر میتوان قوانین مکانیک را بطور آماری و با استفاده از روشهایی که صوریتر و انتزاعیتر از روشهای نظریه جنبشی هستند بکار برد. این رهیافت که توسط جی ویلارد گیبس (J.willard Gibbs) و لودویگ بولتز مانی (Ludwig Boltz manni) (1844 – 1906) و دیگران تکامل یافته است، مکانیک آماری نامیده میشود، که نظریه جنبشی را به عنوان یکی از شاخههای فرعی در بر میگیرد. با استفاده از این روشها میتوان قوانین ترمودینامیک را به دست آورد. بدین ترتیب معلوم میشود که ترمودینامیک شاخهای از علم مکانیک است.
|
|
محاسبه فشار بر پایه نظریه جنبشی
فشار یک گاز ایدهآل را با استفاده از نظریه جنبشی محاسبه میکنند. برای ساده کردن مطلب ، گازی را در یک ظرف مکعب شکل با دیوارههای کاملا کشسان در نظر میگیریم. فرض میکنیم طول هر ضلع مکعب L باشد. سطحهای عمود بر محور X را که مساحت هر کدام e2 است. A1 و A2 مینامیم. مولکولی را در نظر میگیریم که دارای سرعت V باشد. سرعت V را میتوان در راستای یالهای مولفههای Vx و Vy و Vz تجزیه کرد.
اگر این ذره با A1 برخورد کند در بازگشت مولفه X سرعت آن معکوس می شود. این برخورد اثری رو ی مولفه Vy و یا Vy ندارد در نتیجه متغیر اندازه حرکت عبارت خواهد بود :
m Vx - m Vx) = 2 m Vx -) = اندازه حرکت اولیه – اندازه حرکت نهایی
که بر A1 عمود است. بنابراین اندازه حرکتی e به A1 داده میشود برابر با m Vx2 خواهد بود زیرا اندازه حرکت کل پایسته است.
زمان لازم برای طی کردن مکعب برابر خواهد بود با Vx/L. در A2 دوباره مولفه y سرعت معکوس میشود و ذره به طرف A1 باز میگردد. با این فرض که در این میان برخوردی صورت نمیگیرد مدت رفت و برگشت برابر با 2 e Vx خواهد بود. به طوری که آهنگ انتقال اندازه حرکت از ذره به A1 عبارت است:
mVx2/e = Vx/2e . 2 mVx ، برای به دست آوردن نیروی کل وارد بر سطح A1 ، یعنی آهنگ انتقال اندازه حرکتی از طرف تمام مولکولهای گاز به A1 داده میشود.
(P = M/e(Vx12 + Vx22 + Vx32
P = 1/2eV2
|
|
تعبیر دما از دیدگاه نظریه جنبشی
با توجه به فرمول RT 2/3 = 1/2 MV2 یعنی انرژی کل انتقال هر مول از مولکولهای یک گاز ایدهآل ، با دما متناسب است. میتوان گفت که این نتیجه با توجه به معادله بالا برای جور در آمدن نظریه جنبشی با معادله حالت یک گاز ایدهآل لازم است. و یا اینکه میتوان معادله بالا را به عنوان تعریفی از دما بر پایه نظریه جنبشی یا بر مبنای میکروسکوبیک در نظر گرفت. هر دو مورد بینشی از مفهوم دمای گاز به ما میدهد. دمای یک گاز مربوط است به انرژی جنبشی انتقال کل نسبت به مرکز جرم گاز اندازه گیری میشود. انرژی جنبشی مربوط به حرکت مرکز جرم گاز ربطی به دمای گاز ندارد.
حرکت کاتورهای را به عنوان بخشی از تعریف آماری یک گاز ایدهآل در نظر گرفت. V2 را بر این اساس میتوان محاسبه کرد. در یک توزیع کاتورهای سرعتهای مولکولی ، مرکز جرم در حال سکون خواهد بود. بنابراین ما باید چارچوب مرجعی را بکار ببریم که در آن مرکز جرم گاز در حال سکون باشد. در چارچوبهای دیگر ، سرعت هر یک از مولکولها به اندازه U (سرعت مرکز جرم در آن چارچوب) از سرعت آنها در چارچوب مرکز جرم بیشتر است. در اینصورت حرکتها دیگر کترهای نخواهد بود و برای V2 مقادیر متفاوتی بدست میآید. پس دمای گاز داخل یک ظرف در یک قطار متحرک افزایش مییابد. میدانیم که M V2 1/2 میانگین انرژی جنبشی انتقالی هر مولکول است. این کمیت در یک دمای معین که در این مورد صفر درجه سلسیوس است، برای همه گازها مقدار تقریبا یکسانی دارد. پس نتیجه میگیریم که در دمای T ، نسبت جذر میانگین مربعی سرعتهای مولکولهای دو گاز مختلف مساوی است با ریشه دمای عکس نسبت به مربعهای آنها.
T = 2/3k m1 V12/2= 2/3k m2 V22/2
|
|
مسافت آزاد میانگین
در فاصله برخوردهای پیدرپی ، هر مولکول از گاز با سرعت ثابتی در طول یک خط راست حرکت میکند. فاصله متوسط بین این برخوردهای پیدرپی را مسافت آزاد میانگین مینامند. اگر مولکولها به شکل نقطه بودند، اصلا با هم برخورد نمیکردند. و مسافت آزاد میانگین بینهایت میشد. اما مولکولها نقطهای نیستند و بدین جهت برخوردهایی روی میدهد. اگر تعداد مولکولها آنقدر زیاد بود که میتوانستند فضایی را که در اختیار دارند کاملا پر کنند و دیگر جایی برای حرکت انتقالی آنها باقی نمیماند. آن وقت مسافت آزاد میانگین صفر میشد.
بنابراین مسافت آزاد میانگین بستگی دارد به اندازه مولکولها و تعداد واحد آنها در واحد حجم. و به قطر d و مولکولهای گاز به صورت کروی هستند در این صورت مقطع برای برخورد برابر با лd2 خواهد بود.
مولکولی با قطر 2d را در نظر میگیریم که با سرعت V در داخل گازی از ذرات نقطهای هم ارز حرکت میکند. این مولکول در مدت t استوانهای با سطح مقطع лd2 و طول Vt را میروبد. اگر nv تعداد مولکولها در واحد حجم باشد استوانه شامل (лd2 Vt ) nv ذره خواهد بود. مسافت آزاد میانگین ، L ، فاصله متوسط بین دو برخورد پیدرپی است بنابراین ، L ، عبارت است از کل مسافتی که مولکول در مدت t میپیماید. (Vt) تقسیم بر تعداد برخوردهایی که در این مدت انجام میدهد. یعنی:
I = Vt/πd2nv =1/√2πnd2
I = 1/√2πnd2
این میانگین بر مبنای تصویری است که در آن یک مولکول با هدفهای ساکن برخورد میکند. در واقع ، برخوردهای مولکول با هدف دمای متحرک انجام میگیرد در نتیجه تعداد برخورد دما از این مقدار بیشتر است.
توزیع سرعتهای مولکولی
با توجه به سرعت جذر میانگین مربعی مولکولهای گاز ، اما گستره سرعتهای تکتک مولکولها بسیار وسیع است. بطوری که برای هر گازی منحنیای از سرعتها مولکولی وجود دارد که به دما وابسته است. اگر سرعتهای تمام مولکولهای یک گاز یکسان باشند این وضعیت نمیتواند مدت زیاد دوام بیاورد. زیرا سرعتهای مولکولی به علت برخوردها تغییر خواهند کرد. با وجود این انتظار نداریم که سرعت تعداد زیادی از مولکولها بسیار کمتر از Vrms (یعنی نزدیک صفر) یا بسیار بیشتر از Vrms ، زیرا وجود چنین سرعتهایی مستلزم آن است که یک رشته برخوردهایی نامحتمل و موجی صورت بگیرد. مسئله محتملترین توزیع سرعتها در مورد تعداد زیادی از مولکولهای یک گاز را ابتدا کلوک ماکسول حل کرد. قانونی که او ارائه کرد در مورد نمونهای از گاز که N مولکول را شامل میشد چنین است :
N(V) = 4πN(m/2πKt)3/2V2e-mv2/2kt
در این معادله N(V)dV تعداد مولکولهایی است که سرعت بین V و V+3v است، T دمای مطلق ، K ثابت بولتزمن ، m جرم هر مولکول است. تعداد کل مولکولهای گاز (N) را ، با جمع کردن (یعنی انتگرالگیری) تعداد موجود در هر بازه دیفرانسیلی سرعت از صفر تا بینهایت به دست میآید. واحد (N(V میتواند مثلا مولکول برا سانتیمتر بر ثانیه باشد.
N =∫∞0N(V)dv
توزیع سرعتهای مولکولی در مایعات
توزیع سرعتهای مولکولی در مایعات شبیه گاز است. اما بعضی از مولکولهای مایع (آنهایی که سریعترند) میتوانند در دماهایی کاملا پایینتر از نقطه جوش عادی از سطح مایع بگریزند. (یعنی تبخیر شوند). فقط این مولکولها هستند که میتوانند بر جاذبه مولکولهای سطح فائق آیند. و در اثر تبخیر فرار کنند. بنابراین انرژی جنبشی میانگین مولکولهای باقیمانده نیز کاهش مییابد در نتیجه دمای مایع پایین میآید. این امر روشن میکند که چرا تبخیر فرایند سرمایشی است.
بسم الله الرحمن الرحیم
نگاه اجمالی
در ترمودینامیک فقط با متغیرهای ماکروسکوپیک ، مانند فشار و دما و حجم سر و کار داریم. قوانین اصلی ترمودینامیکها بر حسب چنین کمیتهایی بیان میشوند. ابدا درباره این امر که ماده از اتمها ساخته شده است صحبتی نمیکنند. لیکن مکانیک آماری ، که با همان حیطهای از علم سر و کار دارد که ترمودینامیک از آن بحث میکند و وجود اتمها را از پیش مفروض میداند. قوانین اصلی مکانیک آماری حامی قوانین مکانیکاند که در حدود اتمهای تشکیل دهنده سیسنم بکار میروند.
تاریخچه
نظریه جنبشی توسط رابرت بویل (Rabert Boyle) (1627 – 1691) ، دانیل برنولی (1700 – 1782) ، جیمز ژول (1818 – 1889) ، کرونیگ (1822 – 1874) ، رودولف کلاوسیوس (1822 – 1888) و کلرک ماکسول ( 1831 – 1879 ) و عدهای دیگر تکوین یافته است. در اینجا نظریه جنبشی را فقط در مورد گازها بکار میبریم، زیرا برهم کنشهای بین اتمها ، در گازها به مراتب متغیرترند تا در مایعات. و این امر مشکلات ریاضی را خیلی آسانتر میکند.
در سطح دیگر میتوان قوانین مکانیک را بطور آماری و با استفاده از روشهایی که صوریتر و انتزاعیتر از روشهای نظریه جنبشی هستند بکار برد. این رهیافت که توسط جی ویلارد گیبس (J.willard Gibbs) و لودویگ بولتز مانی (Ludwig Boltz manni) (1844 – 1906) و دیگران تکامل یافته است، مکانیک آماری نامیده میشود، که نظریه جنبشی را به عنوان یکی از شاخههای فرعی در بر میگیرد. با استفاده از این روشها میتوان قوانین ترمودینامیک را به دست آورد. بدین ترتیب معلوم میشود که ترمودینامیک شاخهای از علم مکانیک است.
|
|
محاسبه فشار بر پایه نظریه جنبشی
فشار یک گاز ایدهآل را با استفاده از نظریه جنبشی محاسبه میکنند. برای ساده کردن مطلب ، گازی را در یک ظرف مکعب شکل با دیوارههای کاملا کشسان در نظر میگیریم. فرض میکنیم طول هر ضلع مکعب L باشد. سطحهای عمود بر محور X را که مساحت هر کدام e2 است. A1 و A2 مینامیم. مولکولی را در نظر میگیریم که دارای سرعت V باشد. سرعت V را میتوان در راستای یالهای مولفههای Vx و Vy و Vz تجزیه کرد.
اگر این ذره با A1 برخورد کند در بازگشت مولفه X سرعت آن معکوس می شود. این برخورد اثری رو ی مولفه Vy و یا Vy ندارد در نتیجه متغیر اندازه حرکت عبارت خواهد بود :
m Vx - m Vx) = 2 m Vx -) = اندازه حرکت اولیه – اندازه حرکت نهایی
که بر A1 عمود است. بنابراین اندازه حرکتی e به A1 داده میشود برابر با m Vx2 خواهد بود زیرا اندازه حرکت کل پایسته است.
زمان لازم برای طی کردن مکعب برابر خواهد بود با Vx/L. در A2 دوباره مولفه y سرعت معکوس میشود و ذره به طرف A1 باز میگردد. با این فرض که در این میان برخوردی صورت نمیگیرد مدت رفت و برگشت برابر با 2 e Vx خواهد بود. به طوری که آهنگ انتقال اندازه حرکت از ذره به A1 عبارت است:
mVx2/e = Vx/2e . 2 mVx ، برای به دست آوردن نیروی کل وارد بر سطح A1 ، یعنی آهنگ انتقال اندازه حرکتی از طرف تمام مولکولهای گاز به A1 داده میشود.
(P = M/e(Vx12 + Vx22 + Vx32
P = 1/2eV2
|
|
تعبیر دما از دیدگاه نظریه جنبشی
با توجه به فرمول RT 2/3 = 1/2 MV2 یعنی انرژی کل انتقال هر مول از مولکولهای یک گاز ایدهآل ، با دما متناسب است. میتوان گفت که این نتیجه با توجه به معادله بالا برای جور در آمدن نظریه جنبشی با معادله حالت یک گاز ایدهآل لازم است. و یا اینکه میتوان معادله بالا را به عنوان تعریفی از دما بر پایه نظریه جنبشی یا بر مبنای میکروسکوبیک در نظر گرفت. هر دو مورد بینشی از مفهوم دمای گاز به ما میدهد. دمای یک گاز مربوط است به انرژی جنبشی انتقال کل نسبت به مرکز جرم گاز اندازه گیری میشود. انرژی جنبشی مربوط به حرکت مرکز جرم گاز ربطی به دمای گاز ندارد.
حرکت کاتورهای را به عنوان بخشی از تعریف آماری یک گاز ایدهآل در نظر گرفت. V2 را بر این اساس میتوان محاسبه کرد. در یک توزیع کاتورهای سرعتهای مولکولی ، مرکز جرم در حال سکون خواهد بود. بنابراین ما باید چارچوب مرجعی را بکار ببریم که در آن مرکز جرم گاز در حال سکون باشد. در چارچوبهای دیگر ، سرعت هر یک از مولکولها به اندازه U (سرعت مرکز جرم در آن چارچوب) از سرعت آنها در چارچوب مرکز جرم بیشتر است. در اینصورت حرکتها دیگر کترهای نخواهد بود و برای V2 مقادیر متفاوتی بدست میآید. پس دمای گاز داخل یک ظرف در یک قطار متحرک افزایش مییابد. میدانیم که M V2 1/2 میانگین انرژی جنبشی انتقالی هر مولکول است. این کمیت در یک دمای معین که در این مورد صفر درجه سلسیوس است، برای همه گازها مقدار تقریبا یکسانی دارد. پس نتیجه میگیریم که در دمای T ، نسبت جذر میانگین مربعی سرعتهای مولکولهای دو گاز مختلف مساوی است با ریشه دمای عکس نسبت به مربعهای آنها.
T = 2/3k m1 V12/2= 2/3k m2 V22/2
|
|
مسافت آزاد میانگین
در فاصله برخوردهای پیدرپی ، هر مولکول از گاز با سرعت ثابتی در طول یک خط راست حرکت میکند. فاصله متوسط بین این برخوردهای پیدرپی را مسافت آزاد میانگین مینامند. اگر مولکولها به شکل نقطه بودند، اصلا با هم برخورد نمیکردند. و مسافت آزاد میانگین بینهایت میشد. اما مولکولها نقطهای نیستند و بدین جهت برخوردهایی روی میدهد. اگر تعداد مولکولها آنقدر زیاد بود که میتوانستند فضایی را که در اختیار دارند کاملا پر کنند و دیگر جایی برای حرکت انتقالی آنها باقی نمیماند. آن وقت مسافت آزاد میانگین صفر میشد.
بنابراین مسافت آزاد میانگین بستگی دارد به اندازه مولکولها و تعداد واحد آنها در واحد حجم. و به قطر d و مولکولهای گاز به صورت کروی هستند در این صورت مقطع برای برخورد برابر با лd2 خواهد بود.
مولکولی با قطر 2d را در نظر میگیریم که با سرعت V در داخل گازی از ذرات نقطهای هم ارز حرکت میکند. این مولکول در مدت t استوانهای با سطح مقطع лd2 و طول Vt را میروبد. اگر nv تعداد مولکولها در واحد حجم باشد استوانه شامل (лd2 Vt ) nv ذره خواهد بود.
قوانین مکانیک را میتوان بطور آماری در دو سطح مختلف به مجموعهای از اتمها اعمال کرد در سطحی که نظریه جنبشی گازها نامیده میشود. به طریقی کم و بیش فیزیکی و با استفاده از روشهای نسبتا ساده میانگین گیری ریاضی ، عمل میکنیم. برای فهم نظریه جنبشی گاز را در فشار ، دما ، گرمای ویژه و انرژی داخلی این روش را که در سطح بکار برده میشود. نگاه اجمالی در ترمودینامیک فقط با متغیرهای ماکروسکوپیک ، مانند فشار و دما و حجم سر و کار داریم. قوانین اصلی ترمودینامیکها بر حسب چنین کمیتهایی بیان میشوند. ابدا درباره این امر که ماده از اتمها ساخته شده است صحبتی نمیکنند. لیکن مکانیک آماری ، که با همان حیطهای از علم سر و کار دارد که ترمودینامیک از آن بحث میکند و وجود اتمها را از پیش مفروض میداند. قوانین اصلی مکانیک آماری حامی قوانین مکانیکاند که در حدود اتمهای تشکیل دهنده سیسنم بکار میروند. تاریخچه نظریه جنبشی توسط رابرت بویل (Rabert Boyle) (1627 – 1691) ، دانیل بونولی (1700 – 1782) ، جیمز ژول (1818 – 1889) ، کرونیگ (1822 – 1874) ، رودولف کلاوسیوس (1822 – 1888) و کلرک ماکسول ( 1831 – 1879 ) و عدهای دیگر تکوین یافته است. در اینجا نظریه جنبشی را فقط در مورد گازها بکار میبریم، زیرا برهم کنشهای بین اتمها ، در گازها به مراتب متغیرترند تا در مایعات. و این امر مشکلات ریاضی را خیلی آسانتر میکند. در سطح دیگر میتوان قوانین مکانیک را بطور آماری و با استفاده از روشهایی که صوریتر و انتزاعیتر از روشهای نظریه جنبشی هستند بکار برد. این رهیافت که توسط جی ویلارد گیبس (J.willard Gibbs) و لودویگ بولتز مانی (Ludwig Boltz manni) (1844 – 1906) و دیگران تکامل یافته است، مکانیک آماری نامیده میشود، که نظریه جنبشی را به عنوان یکی از شاخههای فرعی در بر میگیرد. با استفاده از این روشها میتوان قوانین ترمودینامیک را به دست آورد. بدین ترتیب معلوم میشود که ترمودینامیک شاخهای از علم مکانیک است. محاسبه فشار بر پایه نظریه جنبشی فشار یک گاز ایدهآل را با استفاده از نظریه جنبشی محاسبه میکنند. برای ساده کردن مطلب ، گازی را در یک ظرف مکعب شکل با دیوارههای کاملا کشسان در نظر میگیریم. فرض میکنیم طول هر ضلع مکعب L باشد. سطحهای عمود بر محور X را که مساحت هر کدام e2 است. A1 و A2 مینامیم. مولکولی را در نظر میگیریم که دارای سرعت V باشد. سرعت V را میتوان در راستای یالهای مولفههای Vx و Vy و Vz تجزیه کرد. اگر این ذره با A1 برخورد کند در بازگشت مولفه X سرعت آن معکوس می شود. این برخورد اثری رو ی مولفه Vy و یا Vy ندارد در نتیجه متغیر اندازه حرکت عبارت خواهد بود : (m Vx - m Vx) = 2 m Vx - )= اندازه حرکت اولیه – اندازه حرکت نهایی که بر A1 عمود است. بنابراین اندازه حرکتی e به A1 داده میشود برابر با m Vx2 خواهد بود زیرا اندازه حرکت کل پایسته است. زمان لازم برای طی کردن مکعب برابر خواهد بود با Vx/L. در A2 دوباره مولفه y سرعت معکوس میشود و ذره به طرف A1 باز میگردد. با این فرض که در این میان برخوردی صورت نمیگیرد مدت رفت و برگشت برابر با 2 e Vx خواهد بود. به طوری که آهنگ انتقال اندازه حرکت از ذره به A1 عبارت است: mVx2/e = Vx/2e . 2 mVx ، برای به دست آوردن نیروی کل وارد بر سطح A1 ، یعنی آهنگ انتقال اندازه حرکتی از طرف تمام مولکولهای گاز به A1 داده میشود. (P = M/e(Vx12 + Vx22 + Vx32 P = 1/2eV2 تعبیر دما از دیدگاه نظریه جنبشی با توجه به فرمول RT 2/3 = 1/2 MV2 یعنی انرژی کل انتقال هر مول از مولکولهای یک گاز ایدهآل ، با دما متناسب است. میتوان گفت که این نتیجه با توجه به معادله بالا برای جور در آمدن نظریه جنبشی با معادله حالت یک گاز ایدهآل لازم است. و یا اینکه میتوان معادله بالا را به عنوان تعریفی از دما بر پایه نظریه جنبشی یا بر مبنای میکروسکوبیک در نظر گرفت. هر دو مورد بینشی از مفهوم دمای گاز به ما میدهد. دمای یک گاز مربوط است به انرژی جنبشی انتقال کل نسبت به مرکز جرم گاز اندازه گیری میشود. انرژی جنبشی مربوط به حرکت مرکز جرم گاز ربطی به دمای گاز ندارد. حرکت کاتورهای را به عنوان بخشی از تعریف آماری یک گاز ایدهآل در نظر گرفت. V2 را بر این اساس میتوان محاسبه کرد. در یک توزیع کاتورهای سرعتهای مولکولی ، مرکز جرم در حال سکون خواهد بود. بنابراین ما باید چارچوب مرجعی را بکار ببریم که در آن مرکز جرم گاز در حال سکون باشد. در چارچوبهای دیگر ، سرعت هر یک از مولکولها به اندازه U (سرعت مرکز جرم در آن چارچوب) از سرعت آنها در چارچوب مرکز جرم بیشتر است. در اینصورت حرکتها دیگر کترهای نخواهد بود و برای V2 مقادیر متفاوتی بدست میآید. پس دمای گاز داخل یک ظرف در یک قطار متحرک افزایش مییابد. میدانیم که M V2 1/2 میانگین انرژی جنبشی انتقالی هر مولکول است. این کمیت در یک دمای معین که در این مورد صفر درجه سلسیوس است، برای همه گازها مقدار تقریبا یکسانی دارد. پس نتیجه میگیریم که در دمای T ، نسبت جذر میانگین مربعی سرعتهای مولکولهای دو گاز مختلف مساوی است با ریشه دمای عکس نسبت به مربعهای آنها. T=2/3k m1 V12/2= 2/3k m2 V22/2 مسافت آزاد میانگین در فاصله برخوردهای پیدرپی ، هر مولکول از گاز با سرعت ثابتی در طول یک خط راست حرکت میکند. فاصله متوسط بین این برخوردهای پیدرپی را مسافت آزاد میانگین مینامند. اگر مولکولها به شکل نقطه بودند، اصلا با هم برخورد نمیکردند. و مسافت آزاد میانگین بینهایت میشد. اما مولکولها نقطهای نیستند و بدین جهت برخوردهایی روی میدهد. اگر تعداد مولکولها آنقدر زیاد بود که میتوانستند فضایی را که در اختیار دارند کاملا پر کنند و دیگر جایی برای حرکت انتقالی آنها باقی نمیماند. آن وقت مسافت آزاد میانگین صفر میشد. بنابراین مسافت آزاد میانگین بستگی دارد به اندازه مولکولها و تعداد واحد آنها در واحد حجم. و به قطر d و مولکولهای گاز به صورت کروی هستند در این صورت مقطع برای برخورد برابر با лd2 خواهد بود. مولکولی با قطر 2d را در نظر میگیریم که با سرعت V در داخل گازی از ذرات نقطهای هم ارز حرکت میکند. این مولکول در مدت t استوانهای با سطح مقطع лd2 و طول Vt را میروبد. اگر nv تعداد مولکولها در واحد حجم باشد استوانه شامل (лd2 Vt ) nv ذره خواهد بود. مسافت آزاد میانگین ، L ، فاصله متوسط بین دو برخورد پیدرپی است بنابراین ، L ، عبارت است از کل مسافتی که مولکول در مدت t میپیماید. (Vt) تقسیم بر تعداد برخوردهایی که در این مدت انجام میدهد. یعنی I = Vt/πd2nv =1/√2πnd2 I=1/√2πnd2 این میانگین بر مبنای تصویری است که در آن یک مولکول با هدفهای ساکن برخورد میکند. در واقع ، برخوردهای مولکول با هدف دمای متحرک انجام میگیرد در نتیجه تعداد برخورد دما از این مقدار بیشتر است. توزیع سرعتهای مولکولی با توجه به سرعت جذر میانگین مربعی مولکولهای گاز ، اما گستره سرعتهای تکتک مولکولها بسیار وسیع است. بطوری که برای هر گازی منحنیای از سرعتها مولکولی وجود دارد که به دما وابسته است. اگر سرعتهای تمام مولکولهای یک گاز یکسان باشند این وضعیت نمیتواند مدت زیاد دوام بیاورد. زیرا سرعتهای مولکولی به علت برخوردها تغییر خواهند کرد. با وجود این انتظار نداریم که سرعت تعداد زیادی از مولکولها بسیار کمتر از Vrms (یعنی نزدیک صفر) یا بسیار بیشتر از Vrms ، زیرا وجود چنین سرعتهایی مستلزم آن است که یک رشته برخوردهایی نامحتمل و موجی صورت بگیرد. مسئله محتملترین توزیع سرعتها در مورد تعداد زیادی از مولکولهای یک گاز را ابتدا کلوک ماکسول حل کرد. قانونی که او ارائه کرد در مورد نمونهای از گاز که N مولکول را شامل میشد چنین است : N(V)=4πN(m/2πKt)3/2V2e-mv2/2kt در این معادله N(V)dV تعداد مولکولهایی است که سرعت بین V و V+3v است، T دمای مطلق ، K ثابت بولتزمن ، m جرم هر مولکول است. تعداد کل مولکولهای گاز (N) را ، با جمع کردن (یعنی انتگرالگیری) تعداد موجود در هر بازه دیفرانسیلی سرعت از صفر تا بینهایت به دست میآید. واحد (N(V میتواند مثلا مولکول برا سانتیمتر بر ثانیه باشد. N =∫∞0N(V)dv توزیع سرعتهای مولکولی در مایعات توزیع سرعتهای مولکولی در مایعات شبیه گاز است. اما بعضی از مولکولهای مایع (آنهایی که سریعترند) میتوانند در دماهایی کاملا پایینتر از نقطه جوش عادی از سطح مایع بگریزند. (یعنی تبخیر شوند). فقط این مولکولها هستند که میتوانند بر جاذبه مولکولهای سطح فائق آیند. و در اثر تبخیر فرار کنند. بنابراین انرژی جنبشی میانگین مولکولهای باقیمانده نیز کاهش مییابد در نتیجه دمای مایع پایین میآید. این امر روشن میکند که چرا تبخیر فرایند سرمایشی است. مثال واقعی در مورد توزیع سرعتهای مولکولی با توجه به فرمول N(V)= Σ410N(M/2πkT)3/2 توزیع سرعتهای مولکولی هم به جرم مولکول و هم به دما بستگی دارد هرچه جرم کمتر باشد نسبت مولکولهای سریع در یک دمای معین بیشتر است. بنابراین احتمال اینکه هیدروژن در ارتفاعات زیاد از جو فرار کند بیشتر است، تا اکسیژن و ازت. کره ماه دارای جو رقیقی است. برای آنکه مولکولهای این جو احتمال زیادی برای فرار از کشش گرانشی ضعیف ماه ، حتی در دماهای پایین آنجا نداشته باشند، انتظار میرود که این مولکولها یا اتمها متعلق به عناصر سنگینتر باشند. طبق شواهدی ، در این جو گازهای بی اثر سنگین مانند کریپتون و گزنون وجود دارند که براثر واپاشی پرتوزا در تاریخ گذشته ماه تولید شدهاند. فشار جو ماه در حدود 10 برابر فشار جو زمین است. توزیع ماکسولی ماکسول قانون توزیع سرعتهای مولکولی را در سال 1859 میلادی به دست آورد. در آن زمان بررسی این قانون به کمک اندازه گیری مستقیم ممکن نبود و در حقیقت تا سال 1920 که اولین کوشش جدی در این راه توسط اشترن (Stern) به عمل آمد، هیچ اقدامی صورت نگرفته بود. افراد مختلفی تکنیکهای این کار را به سرعت بهبود بخشیدند. تا اینکه در سال 1955 یک بررسی تجربی بسیار دقیق در تائید این قانون (در مورد مولکولهای گاز توسط میلر (Miller) و کاش (Kusch) از دانشگاه کلمبیا صورت گرفت. اسبابی که این دو نفر بکار بردند در مجموعهای از آزمایشها مقداری تالیوم در کوره قرار میدادند و دیوارههای کوره O را تا دمای یکنواخت 80±4K گرم کردند. در این دما تالیوم بخار میشود و با فشار 3.2x10-3 میلیمتر جیوه ، کوره را پر میکند. بعضی از مولکولهای بخار تالیوم از شکاف s به فضای کاملا تخلیه شده خارج کوره فرار میکند و روی استوانه چرخان R میافتند در این صورت استوانه که طولش L است تعدادی شیار به صورت مورب تعبیه شده که فقط یکی از آنها را میتوان دید. به ازای یک سرعت زاویهای معین استوانه (W) فقط مولکولهایی که دارای سرعت کاملا مشخص V هستند میتوانند بدون برخورد با دیوارهها از شیارها عبور کنند. سرعت V را میتوان از رابطه زیر بدست آورد: V=LW/q و L/V= φ/W = زمان عبور مولکول از شیار φ : تغییر مکان زاویهای بین ورودی و خروجی یک شیار مورب است. استوانه چرخان یک سرعت گزین است، سرعت انتخاب شده با سرعت زاویهای (قابل کنترل) W متناسب است. نقص توزیع سرعت ماکسولی با نظریه جنبشی اگرچه توزیع ماکسولی سرعت برای گازها در شرایط عادی سازگاری بسیار خوبی با مشاهدات دارد. ولی در چگالیهای بالا ، که فرضهای اساسی نظریه جنبشی کلاسیک صادق نیستند. این سازگاری نیز به هم میخورد. در این شرایط باید از توزیعهای سرعت مبتنی بر اصول مکانیک کوانتومی ، یعنی توزیع فرمی - دیراک (Fermi Dirac) بوز – انیشتین (Bose Einstein) استفاده کرد. این توزیعهای کوانتمی در ناحیه کلاسیک ( چگالی کم ) با توزیع ماکسولی توافق نزدیک دارند و در جایی که توزیع کلاسیک با شکست مواجه میشود با نتایج تجربی سازگارند. بنابراین در کاربرد توزیع ماکسولی محدودیتهایی وجود دارد. همانگونه که در واقع برای هر نظریهای چنین است.





 آمار
وب سایت:
آمار
وب سایت:

